開發新型適配體 為治療癌症和神經系統疾病帶來轉機
G-四鏈體結構(G-quadruplexes,簡稱G4)是去氧核糖核酸(DNA)和核糖核酸(RNA)中的特殊結構,對細胞具有重要作用,並與癌症和神經系統疾病有所關聯。香港城市大學(城大)的研究團隊最近建立了一個全新的平台,能夠選擇靶向G4結構的L-RNA適配體(aptamers)。該平台成功篩選出一種L-RNA適配體,能結合至特定的G4拓撲結構(平行G4)。這一研究發現有助於開發治療與G4相關疾病(如癌症)的新藥物和治療方法。
該研究成果已發表在知名期刊《核酸研究》(Nucleic Acids Research)上,題為<Selective targeting of parallel G-quadruplex structure using L-RNA aptamer>。
在傳統方法上,如有機小分子、抗體和多肽已被用於靶向G4,然而只有少數能與特定的G4構象形成相互作用。此外,這些方法在基因調控方面的應用,特別是在內源基因水平上的應用,尚未得到廣泛研究,存在著重大的研究和知識差距。為克服這個問題,建立能夠特異性靶向特定的G4構象的通用平台和新型工具有重大意義。
城大化學系郭駿傑教授解釋道:「作為D-RNA的非天然對映體形式,L-RNA適配體是一種有前景的新型核酸靶向工具,儘管它們的開發仍處於早期階段,迄今為止只有少數的功能性核酸靶標進行了研究。」
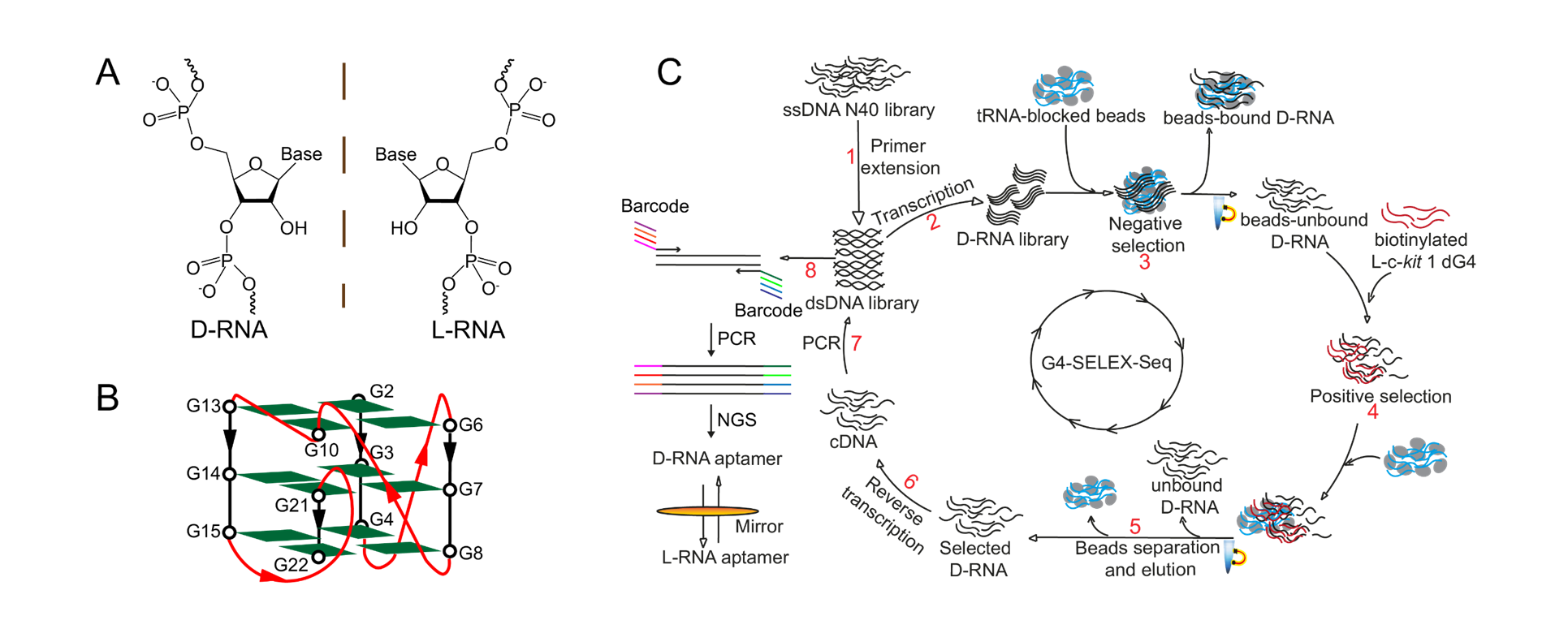
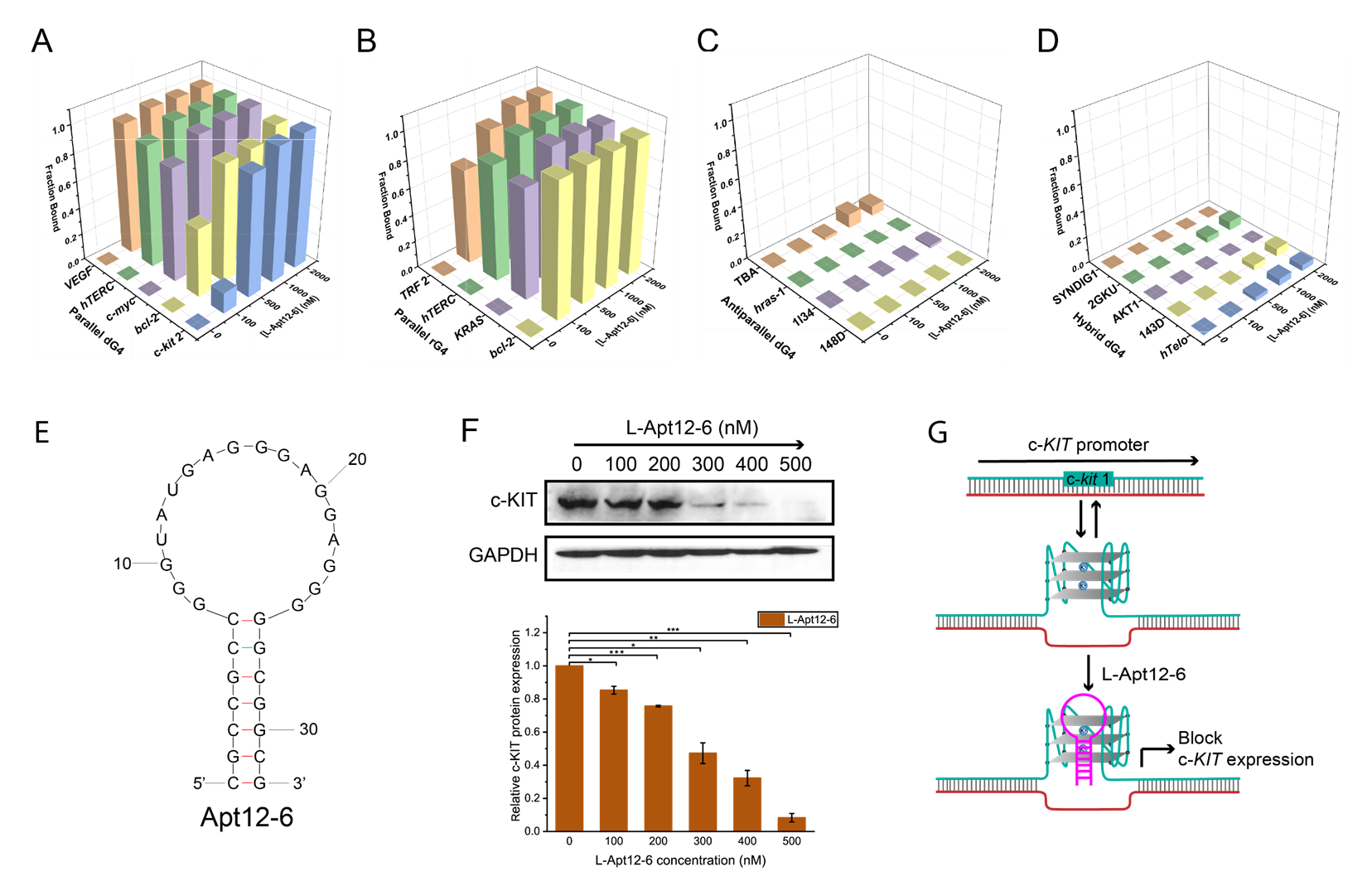
他說:「在這項研究中,我們首次引入了一種新型的高通量的L-RNA適配體篩選方法,稱為G4-SELEX-Seq。通過使用這個新型篩選方法,我們鑒定出一種新L-RNA適配體,名為L-Apt12-6。它能特異性識別平行G4結構。這也是首個能夠特異性靶向平行G4構象的L-RNA適配體。更重要的是,我們還證明了L-Apt12-6可以控制癌細胞中原癌基因c-kit1的基因表達。」
研究論文的第一作者及目前在郭教授實驗室中的擔任博士後研究員的姬丹陽博士補充說:「我們花費逾一年時間對適配體選擇平台進行反覆的故障排除和改進。SELEX過程中的非特異性富集阻礙了有效結合序列的篩選。」為了克服這個問題,他們採用了高通量的二代測序(NGS)全面分析富集的文庫。郭教授及姬博士興奮地指出:「這個過程就如大海撈針!」。經過多次嘗試後,成功確定了一個適用於下游應用的候選適配體序列。
「新開發的SELEX策略(即G4-SELEX-Seq),可以通過適當的改進用於其他核酸結構。」郭教授強調新策略的普遍應用潛力。
新篩選出來的L-Apt12-6在選擇性地識別G-四鏈體構象方面具有重要價值。它表現出在體外和細胞內調控G4介導的基因活性的能力。通過連接各種功能模組的蛋白、多肽、核酸或配體,L-Apt12-6可以進一步定制,使其在廣泛的環境中,包括生物醫學和生物技術領域,得以應用。

如有查詢,歡迎聯絡城大化學系郭駿傑教授(電郵: ckkwok42@cityu.edu.hk)。