可生物降解納米纖維多足機械人,有望用於消化道進行可控定點藥物治療
由香港城市大學(城大)學者領導的一項研究,成功制作出可以生物降解的納米纖維多足機械人Fibot。這納米機械人不但可於腸道內行走,更可因應環境的酸鹼值而降解,到不同的預定腸道位置定點釋放不同的藥物。這項研究為微型機械人的開發提供啟示,有望用於在消化道進行可控的定點藥物治療,亦促進可生物降解和具有環境適應性的裝置於生物醫學範疇的應用。
研究團隊由城大生物醫學工程學系(BME)的副教授申亞京博士領導。研究結果已於學術期刊《Matter》上發表,題為〈Nanofiber-based biodegradable millirobot with controllable anchoring and adaptive stepwise release functions〉。
城大申亞京博士的研究團隊,成功制作出可以生物降解的納米纖維多足機械人Fibot。透過調整材料成分,Fibot可以按環境的pH值變化而可控地降解,在預定的位置逐步釋放藥物。(DOI number: 10.1016/j.matt.2022.01.023)
所謂「錨定」,意即當Fibot走到腸道指定位置時,能固定在那裡,而不受消化道蠕動所影響。Fibot由外在磁場驅動而行走,其多足的設計令它即使在復雜的體內環境中也能有效移動,當增強磁力就可以令Fibot於腸壁內「錨定」。
兔子活體實驗證明Fibot經過4小時後徹底降解
申博士解釋說:「Fibot的足部可以穿入腸黏膜層,於指定的腸道位置『錨定』,不致被消化道的蠕動推走,為在指定位置釋放所攜帶的藥物提供基礎;由於磁力操控適度,Fibot足部不會觸及消化道的黏膜下層和肌外層,避免了刺穿腸道的風險。」
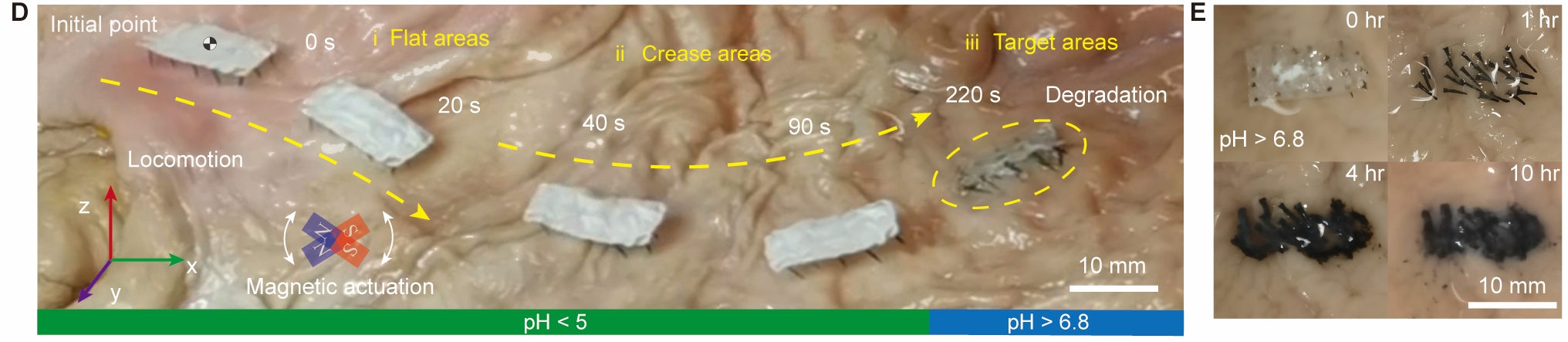
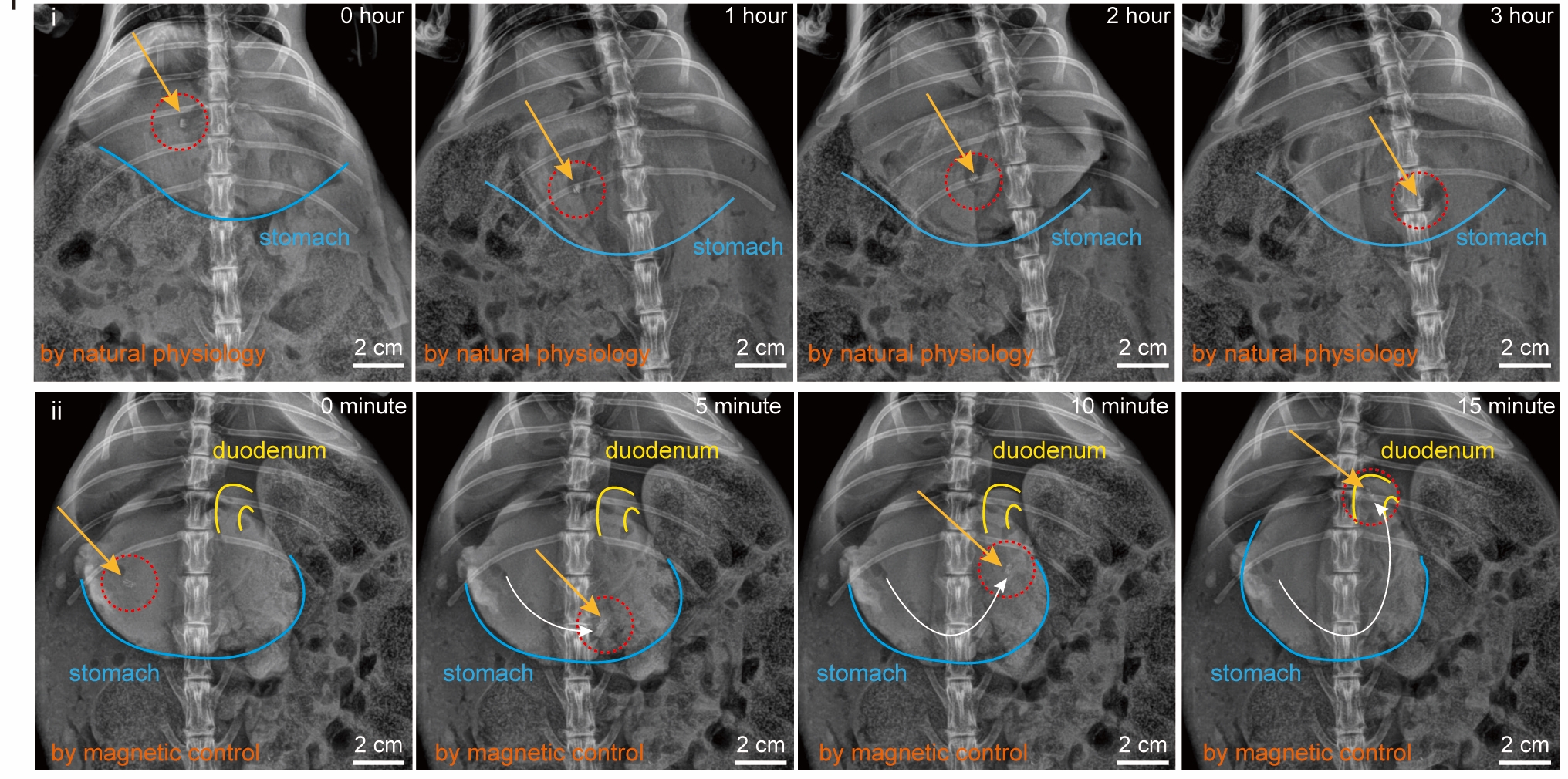
研究人員對Fibot進行了不同實驗,例如:把它放於豬隻凹凸不平、濕滑、酸性(pH值為5)的胃部,證實在磁場驅動下,它於10秒內行走了7釐米,反映其於胃部環境內的行走能力。他們把Fibot置於兔子身上進行活體實驗,當Fibot進入消化道,並走到指定位置時,研究人員利用增強了的磁場,成功將它「錨定」於腸道組織上,其間Fibot一直停留原位,只是隨著時間而逐步降解,直至4小時後徹底降解。
用對不同pH值產生反應而降解的材料 實現可控的藥物釋放
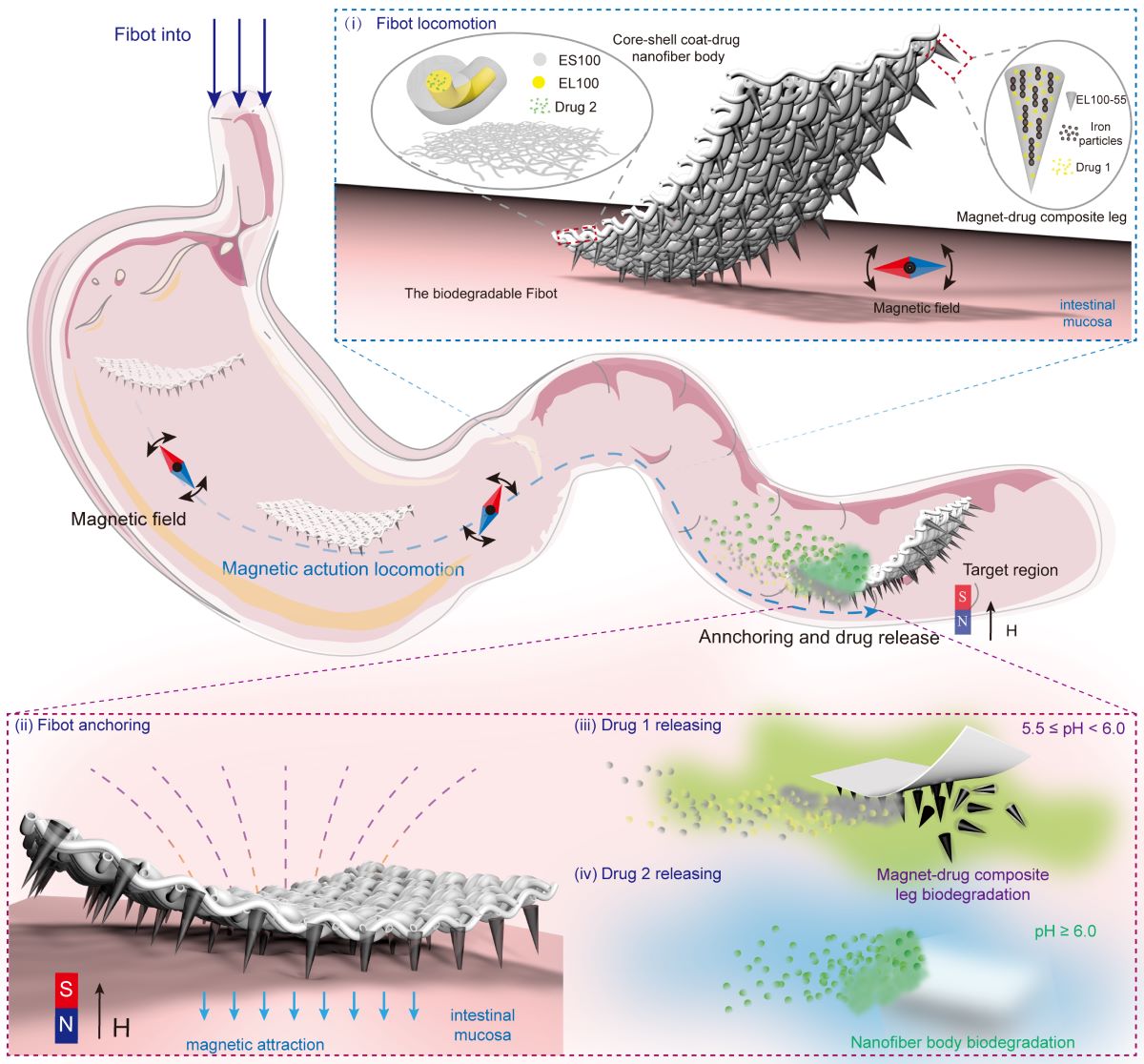
Fibot另一特點是能夠釋放不同的藥物,關鍵在於它的制成材料。研究人員用可生物降解的物料制作出納米纖維,再分別制成柔性薄膜狀的「身體」以及一排排的針狀足部。然後研究人員通過靜電紡絲(electrospinning)在磁力輔助下,將Fibot的身體和足部組裝起來。
組成Fibot身體的納米纖維具有核殼(core-shell)的特別結構,藥物可以藏於殼內。研究人員同時調整物料成份並混入藥物,制成針狀足部。申博士說:「只要我們在制作過程中調整物料,身體和足部這兩部分會於不同pH值下被降解,令我們可以控制被包裹的不同藥物逐步從Fibot的身體和足部釋放。」
團隊的實驗證明,即使在胃部等這些pH值少於或等於5的酸性環境裡,Fibot整體的結構依然穩定,不會泄漏包裹著的藥物;而當Fibot身處pH值大於或等於5.5的環境,足部就會慢慢溶解,並於超過40分鐘的時間逐步釋放所攜帶的藥物,而身體仍然保持完整,可以繼續受外在磁力牽引而行走;當身處於pH值大於6的環境中,Fibot剩余的身體會在7小時內被完全降解,釋放出另一種藥物。
研究證實Fibot具完全生物相容性,可安全作生物醫學用途
申博士進一步說:「活體實驗證實Fibot擁有完全的生物相容性,亦能完全生物降解,所以不會阻塞腸道。「錨定」於腸道組織亦沒有引起任何炎症反應,可以安全作生物醫學用途。」
Fibot為設計可完全生物降解、能於目標位置「錨定」逐步釋放藥物的功能性微型機械人帶來了啟示,而且或可用於未來的目標位置遞送和可編程釋放等醫療操作,以及臨床應用的腸道大分子遞送。申博士總結說:「Fibot不但為局部位置的治療提供了新的解決方案,也為透過皮膚釋放大分子藥物的做法提供了實現機會。」

申博士是論文的通訊作者。來自城大BME的博士候選人譚蓉和楊雄均是第一作者。申博士團隊內的博士畢業生陸豪健博士以及博士生楊柳、張鐵山、苗佳麒、豐雨亦有參與這次研究。
是次研究獲得國家自然科學基金、深圳市基礎研究重點項目和香港研究資助局的資助而進行。
DOI number: 10.1016/j.matt.2022.01.023
