檢測早期腦腫瘤的嶄新非侵入性液態活檢技術
惡性神經膠質瘤是最常見的一種原發腦癌,由於難以在早期被診斷等問題,因此確診時多已是晚期,幾近藥石無靈。近期,香港城市大學(香港城大)一支跨學科的研究團隊便在血清中新發現一種生物標誌物,透過他們改良的無標記式生物傳感器,能定量檢測出這種標誌物,以便在早期就能檢測出神經膠質瘤。研究成果令對神經膠質瘤進行非侵入性的液態活檢變得可行,有望成為未來具有潛力的診斷工具。
該項研究由香港城大神經科學系的李永鎮博士,以及材料科學及工程學系胡志文教授共同領導。研究成果已在學術期刊《科學進展》(Science Advances)上發表,題為〈Label-free sensing of exosomal MCT1 and CD147 for tracking metabolic reprogramming and malignant progression in glioma〉。
癌細胞的代謝特徵
惡性神經膠質瘤細胞增生時的一個特徵,是腫瘤細胞為了生存而出現的一種代謝途徑重編程(metabolic reprogramming)現象。與正常細胞相比,癌細胞可以在沒有氧氣的情況下存活;而且即使在氧含量正常的情況下,癌細胞仍會偏好利用糖酵解(glycolysis)來製造能量,促進癌細胞的存活及增生。糖酵解本身是指無氧下,將葡萄糖轉化為高能分子的代謝過程。因此,腫瘤細胞的糖酵解往往被稱為「有氧糖酵解」(aerobic glycolysis)或瓦伯格效應(Warburg’s effect),以便與正常細胞的無氧糖酵解分別出來。
糖酵解的過程會產生出大量的乳酸,對癌細胞有害,因此癌細胞會製造出更多的單羧酸轉運蛋白1(MCT1,一種主要的乳酸轉運蛋白)和它們的結合蛋白CD147,作用是將乳酸排走到細胞之外,令糖酵解得以維持進行,持續產生能量,令腫瘤細胞存活。所以,很多研究都提出,神經膠質瘤細胞中的MCT1和CD147,可以被視為診斷和治療惡性神經膠質瘤的生物標誌物。
不過,本身是神經科學家的李博士說:「儘管大多數研究都集中鑽研神經膠質瘤細胞或基因,但是我們對神經膠質瘤細胞通過外泌體(exosomes)與附近的細胞所產生的相互作用更感興趣。」
外泌體是直徑大約為30至200納米的囊泡,由神經膠質瘤細胞釋放出來,含有與腫瘤相關的信使核糖核酸(messenger RNA, mRNA)和變異的蛋白質。外泌體亦會將致癌分子轉運到鄰近細胞,以促進腫瘤的生長。外泌體更可以穿過血腦屏障(the blood-brain-barrier)和血腦脊液屏障(the blood-cerebrospinal fluid barrier),因此可以在血液中被檢測到。
外泌體中新發現的生物標誌物
在這次研究中,團隊發現神經膠質瘤細胞中的MCT1和CD147實際上控制了外泌體的釋放以及其成份。論文的第一作者、神經科學系的研究助理Abhimanyu Thakur博士說:「這個發現意味著減少MCT1和CD147的數量能達致抗癌的效果:不單能抑制癌細胞的生長,亦可以透過外泌體阻止癌細胞與附近細胞的互動,例如阻截外泌體將致癌分子轉運到其他細胞。」
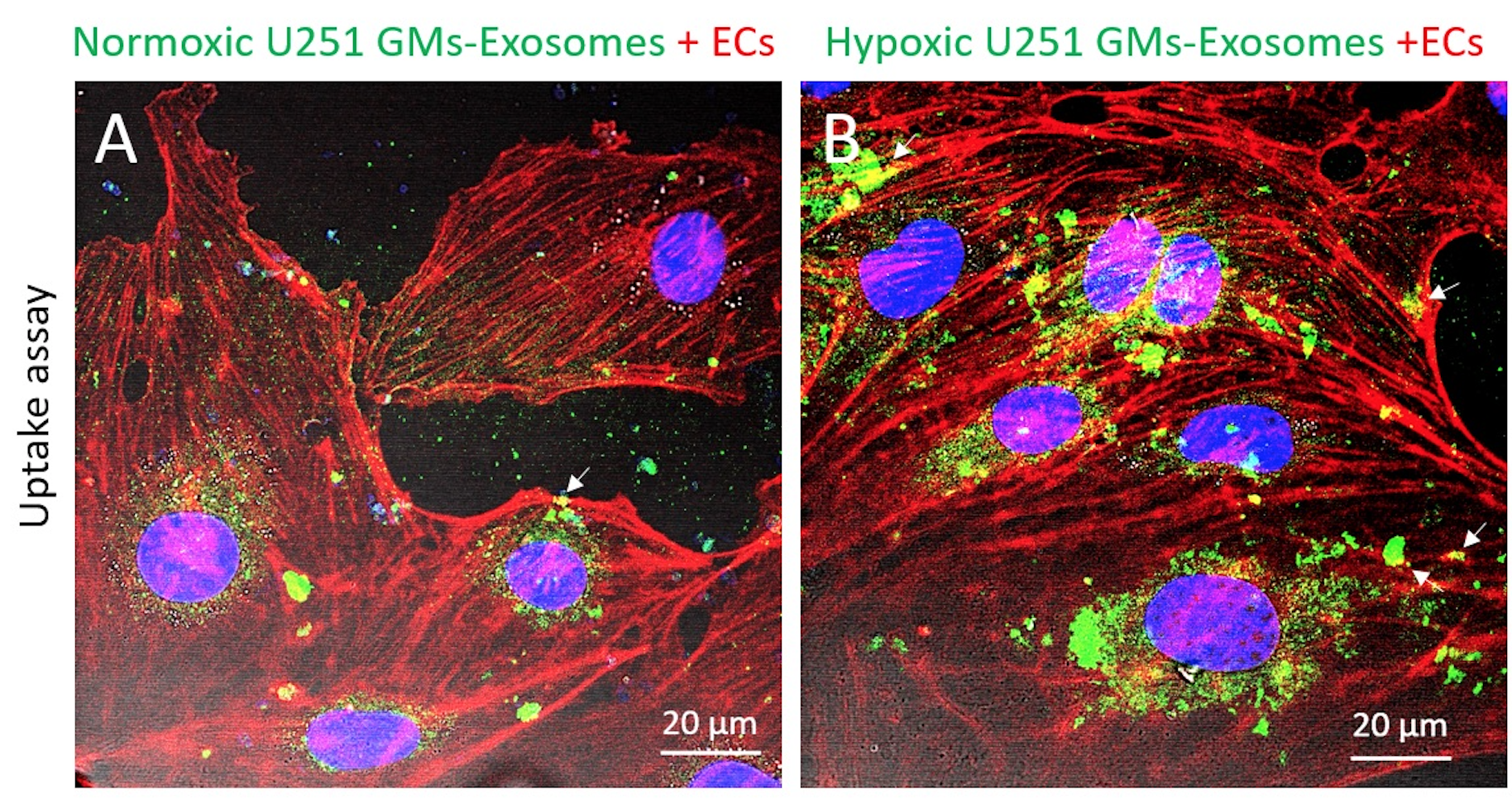
更重要的是,研究團隊發現外泌體亦含有MCT1和CD147,而且當神經膠質瘤細胞在缺氧環境下增生時,外泌體中的MCT1和CD147的水平都升高了。研究團隊進行的定量分析進一步顯示,外泌體中的MCT1和CD147的水平,能夠反映神經膠質瘤細胞中的MCT1和CD147水平。這意味著外泌體中的MCT1和CD147亦可用作追蹤惡性神經膠質瘤增生的生物標誌物。
非侵入性兼無標記式的傳感技術
那麼如何量度外泌體中的MCT1和CD147的水平呢?
目前醫學界主要用磁力共振成像(MRI)、電腦斷層成像掃描(CT)以及腦部組織活檢,來診斷和追蹤病人神經膠質瘤的增生情況。但是礙於解像度有限,MRI和CT掃描無法在分子層面上進行檢測,大多只能確認已發展至較晚期的神經膠質瘤,而活檢的方法則具侵入性,均有其不足之處。
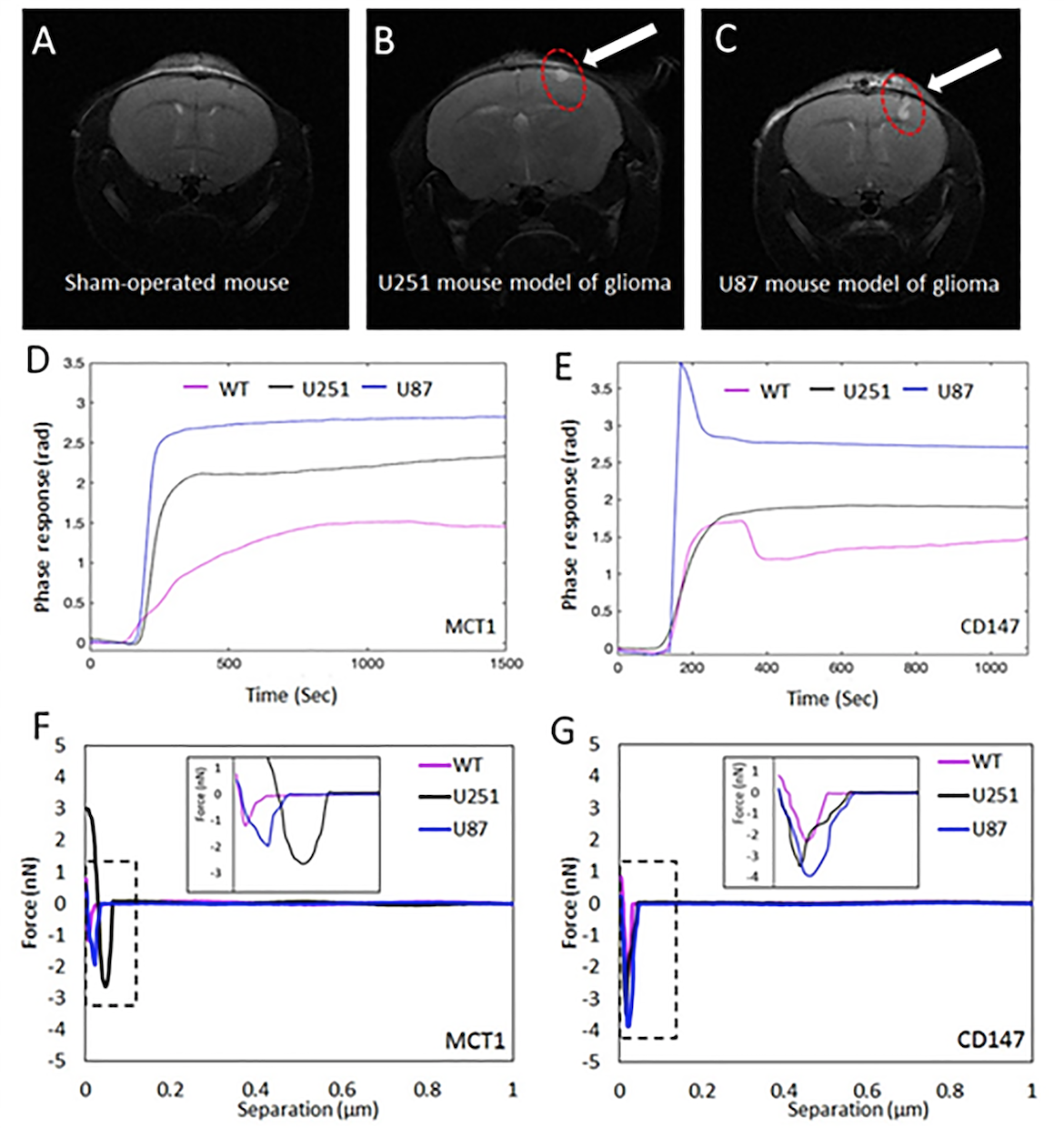
研究團隊運用由吳教授及其博士生們改良了的局域表面等離子體共振(localized surface plasmon resonance, LSPR)生物傳感器和原子力顯微鏡(atomic force microscopy, AFM)生物傳感器,成功準確定量檢測到由神經膠質瘤細胞釋放的外泌體中的MCT1和CD147水平。

LSPR技術透過偵測置於傳感器表面的測試溶液在折射率上的微小變化,可檢測出不同單一分子間的相互作用,包括抗原與抗體之間或蛋白質與蛋白質之間的相互作用,是一種具有高靈敏度的技術。而AFM則是具有高解像度(精細至納米級)的掃描探針顯微鏡,用於分析外泌體等生物樣本。
LSPR和AFM這兩種方式都具有成本效益、實時、靈敏度高的特性,而且「無需標誌物」,意思是檢測時不需要用上造影劑。胡教授解釋道:「一般標示標誌物的過程既費工夫又昂貴。這次我們運用無標記式的生物傳感技術,在不用為外泌體作標記的情況下,仍然能檢測到它們。」
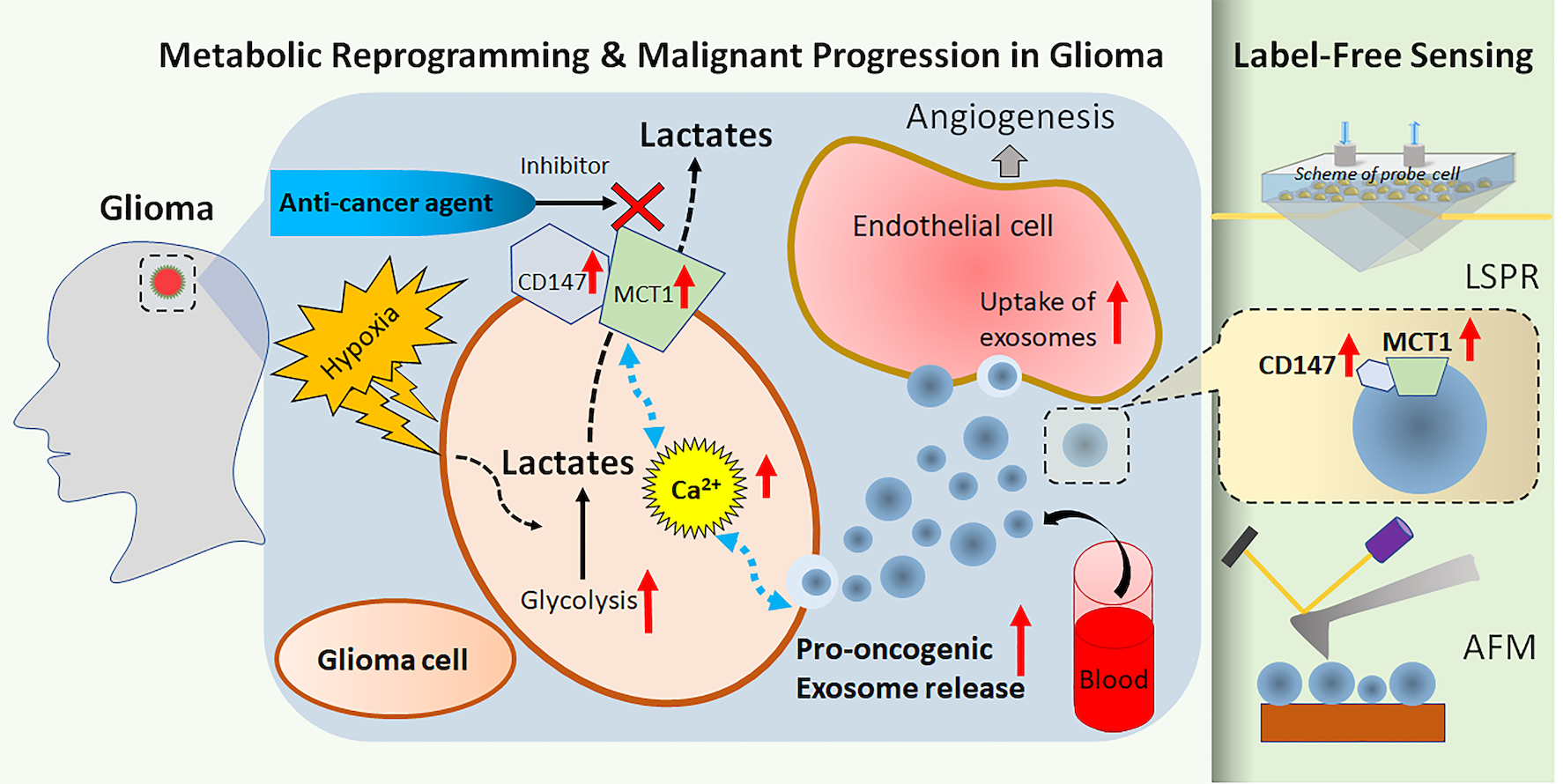
胡教授的團隊改良LSPR和AFM的方法,是在傳感器芯片的表面加上一層特別的納米金顆粒層。師從胡教授、參與此項研究的博士生徐晨解釋說:「這個做法不僅可以提升LSPR的靈敏度,也令AFM有更高的解像度。」
為了測試經改良的LSPR和AFM生物傳感器的性能,研究團隊使用了分別由培植的人腦神經膠質瘤細胞所釋放的外泌體,以及從患有神經膠質瘤小鼠的血清裡分離出來的外泌體,來進行實驗。實驗所得出的正面結果,強而有力地證明了LSPR和AFM生物傳感器在監測神經膠質瘤細胞的惡性增生具有應用潛力,有望應用於早期檢測及作更佳的診斷。
或可應用於檢測神經疾病
「我們的研究顯示,神經細胞的代謝變化可以透過改變外泌體的相互作用而加促疾病演進。進一步研究神經疾病中,代謝途徑重編程與外泌體和其他細胞互動改變,這兩者之間的關聯,會是個有趣的課題。」李博士補充說。「透過使用無標記式的LSPR和AFM生物傳感器來檢測外泌體生物標誌物,或可應用於阿兹海默症、柏金遜症和肌萎縮性脊髓側索硬化症等神經系統疾病的診斷。」
研究團隊的成員均來自香港城大。除了李博士、胡教授、Thakur博士以及徐晨,其他成員包括來自神經科學系的楊甜、來自MSE學系的邱廣宇博士和吳兆鵬博士、以及來自生物醫學工程學系的陳葦恩博士與韓雄奇。

這項研究獲得香港城大及香港研究資助局的資助進行。
DOI number: 10.1126/sciadv.aaz6119
