潜力无限!城大化学家研发新型的独特RNA结构靶向工具,为癌症治疗研究提供新思路
负责将储存在DNA内的遗传密码解码并产生蛋白质的核糖核酸(Ribonucleic acids, RNAs),会折叠成不同的结构,以控制包括人类在内的各种生物的基本生理过程。而透过小分子来找出与疾病相关的RNA结构,一直是科学界研发靶向RNA药物(RNA-targeting drugs)的金科玉律。最近,香港城市大学(城大)的研究团队便开发了一种新型的RNA结构靶向工具,毋须靶向小分子,依然能针对地识别出与癌症和神经系统疾病等有关的独特四链(four-stranded)RNA结构。团队的发现或有助于进一步开发出相关疾病的治疗工具。
研究由来自城大化学系及海洋污染国家重点实验室的副教授郭骏杰博士领导,研究结果已于学术期刊《Nature Protocols》上发表,题为〈Development of RNA G-quadruplex (rG4) targeting L-RNA aptamers by rG4-SELEX〉。
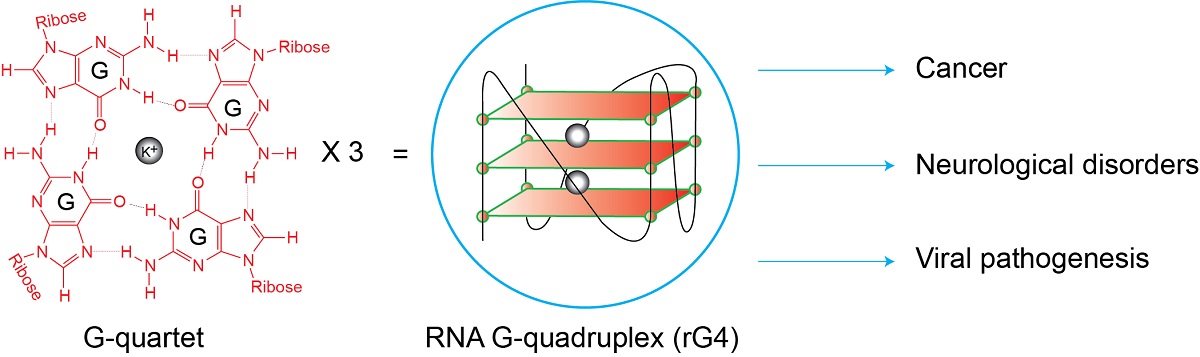
与癌症和神经系统疾病相关的RNA G-四链体
郭博士说:“我们是全球首个研究团队,成功研发出一种新型的工具,能够靶向RNA G-四链体(RNA G-quadruplex,简称rG4)的L-RNA核酸适体(aptamers)。我们的研究数据表明,这些新开发的L-RNA核酸适体能选择性地靶向特定的rG4目标,并精准地与之结合,表现更比现时最前沿的rG4靶向小分子更好。”他形容团队的研究成果“令人鼓舞”,并说:“我们的成果为选择性靶向rG4提供了崭新及重要的方向,而且可能适用于靶向DNA和RNA中其他不常见的核酸结构。”
那到底什么是RNA G-四链体呢?RNA G-四链体简称rG4,是由RNA序列形成的一种特殊结构,见于人类、植物、细菌和病毒中,能成为结构“支架”让蛋白质结合形成,并发挥不同的生物学功能。个别的rG4已被发现于细胞中具有重要的功能和扮演基因调控的角色,近期的研究还发现了rG4与癌症、神经系统疾病和病毒致病机理有关。
而要进一步钻研rG4,首先就要找到它们。一直以来,靶向功能性rG4的主要方法是运用小分子配体(ligands),即是分子量(molecular weight)轻的有机或无机化合物。郭博士解释道:“不过大多数的rG4配体都无法区分具有相似结构的rG4,这对要选择性靶向指定rG4以进行基因调控,构成一大挑战。”
全新解决方案︰以崭新L-RNA核酸适体靶向rG4
为克服上述挑战,郭博士和他的团队研发出“基于L-RNA核酸适体以靶向rG4”的全新解决方案,为科研界解决长期存在的问题。核酸适体是单链、短的DNA或RNA分子,折叠成特定结构,并与金属离子和蛋白质等特定目标结合。
郭博士和团队花上将近两年的时间,建立起他们命名为“rG4-SELEX”的核酸适体拣选平台,研发出可以靶向特定rG4的不同L-RNA核酸适体。
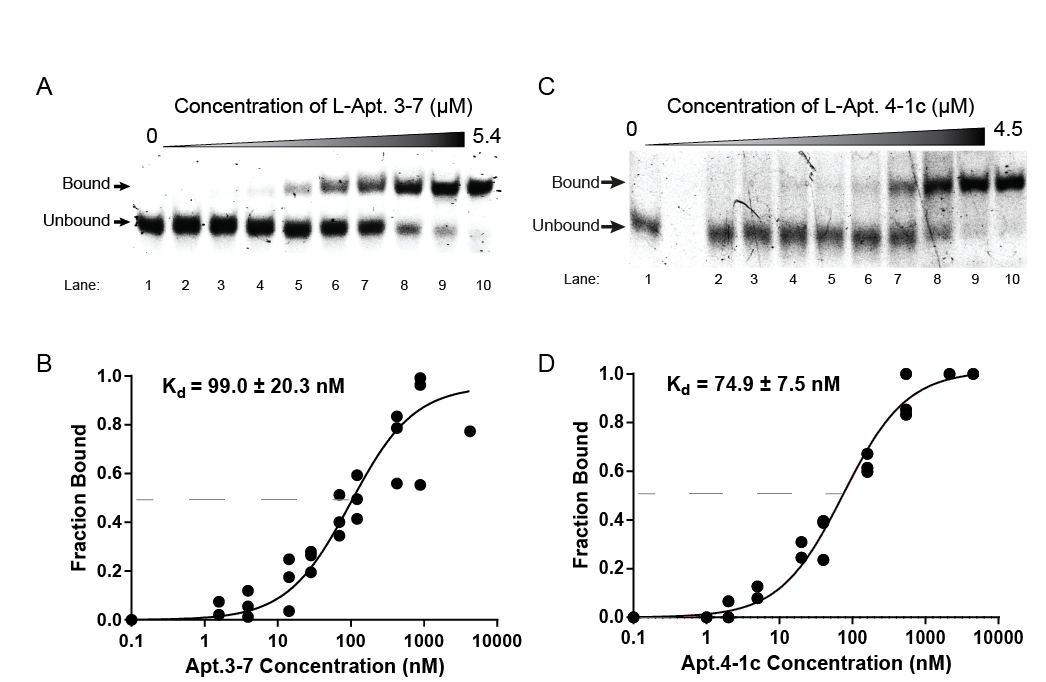
他们在实验中发现,被他们称为“L-Apt.3-7”的其中一种L-RNA核酸适体,可以与其目标rG4紧密结合,而且在实验中没有混淆其他类似的rG4结构。这个结果可谓是首次发现到运用L-RNA核酸适体,可以选择性靶向rG4。
团队还证明了L-RNA核酸适体可用来干扰rG4与蛋白质之间的相互作用,从而截停其生化和细胞功能,加以调控的话,或可作治疗。根据团队的实验结果,相对于目前最前沿的rG4靶向配体,L-RNA核酸适体的表现可以匹敌,甚至有过之而无不及。
潜力无限,日后或可用于治疗疾病
郭博士总结说:“在这次研究中,我们首次引入了能帮助大力开发L-RNA核酸适体的通用框架,以用于靶向与生物学和治疗相关的rG4结构,和找出rG4-蛋白质之间的相互作用。我们的研究结果提供了新的靶向策略,日后或可用于治疗疾病。”
郭博士和他的团队目前正研究以靶向rG4的L-RNA核酸适体,来靶向人体的编码RNA和解码RNA之中数个与疾病相关的rG4结构,和rG4-蛋白质的相互作用。

郭博士预计进一步完善这个核酸适体拣选的平台后,将能够用高通量的方式开发出不同的L-核酸适体,以靶向RNA结构,从而或可应用于治疗如 COVID-19的人类疾病。他补充说:“我坚信追求技术上的创新自然会推动我们探索生物学,并衍生更深入的理解。”
郭博士是论文的通讯作者。而来自城大化学系及海洋污染国家重点实验室的Umar Mubarak Ishaq博士和陈俊彦先生均是第一作者。
是次研究获得城大、香港研究资助局、裘槎基金会、深圳市基础研究项目和香港城大海洋污染国家重点实验室的资助而进行。
DOI number: 10.1038/s41596-022-00679-6
本文于 “香港城大研创” 微信公众号发布。
Wechat ID: CityU_Research

